我們知道,癌細胞具有不死且不斷增生的能力,其中細胞週期失控為一重要原因。正常細胞在生長分裂時,受到許多轉錄調節因子以及各種蛋白質的精密調控,當這些調節因子或是蛋白質突變、不正常表現時(如p53、CDK4、CDK6等),細胞將會永無止境的不斷分裂下去,進而變成腫瘤(Kastan & Bartek, 2004; Malumbres & Barbacid, 2009)。
細胞週期為細胞生長的過程,可分為G0期、G1期、S期、G2期、M期,每個週期中間都有檢查點確認該期的流程是否有出錯,若有出錯,則細胞週期將停滯在該期,並往細胞凋亡的方向發展(Schafer, 1998)。
試想,若今天能找到小分子化合物或是天然化合物能夠使癌細胞的細胞週期停滯,便能夠阻止癌細胞永無止境的生長,如治療乳癌的藥物Palbociclib (愛乳適)、Ribociclib (瑞博西利)、abemaciclib (Verzenio ®)等,便是針對CDK4/CDK6的抑制劑。
那麼,在研究上,我們如何去判斷潛在的藥物是否有抑制癌細胞週期的能力呢?通常透過流式細胞儀,以propidium iodide (PI)進行核酸染色即可,而其原理與特性,我們接著介紹。

Fig.1 .細胞週期圖形。https://jackwestin.com/resources/mcat-content/mitosis/phases-of-cell-cycle-g0-g1-s-g2-m
首先我們要認識propidium iodide (PI),PI是一種具有螢光特性的核酸染劑,能與細胞內的DNA與RNA結合,他的螢光特性如(Fig. 2)所示,在535 nm時有最大激發波長,在617 nm時有最大發散波長 (但在實驗中,488 nm藍光雷射、561 nm 黃光雷射也很常用來激發PI),PI具有不通透細胞膜的特性,故執行染色前,通常會用75%或90%酒精進行固定,並使細胞膜破裂,方便PI與細胞內的核酸結合,除此之外,因PI也會與RNA結合,故執行實驗的過程中,也會加入RNAse,避免RNA干擾,造成較高的背景。

Fig.2 . PI染劑的光學特性。
接著我們就要討論,為何要對核酸進行染色呢?因為細胞週期中,每個時期的DNA含量是不一樣的。G0 phase為細胞靜止期,G1 phase時期的細胞,會為了DNA的複製做準備,但此時DNA的含量為Diploid (2N)二倍體,接著進入到S phase,此期的細胞將開始進行DNA的複製,染色體複製完後,及會進入G2 phase,此期的細胞DNA的含量為Tetraploid (4N)四倍體,確保DNA無複製錯誤並繼續生長後將進入最後一個分裂期M phase。
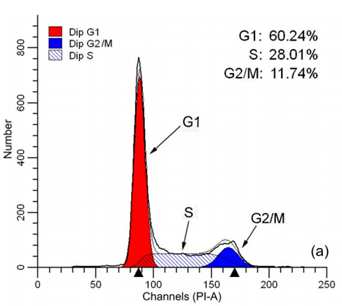
Fig.3 . 肝癌細胞HepG2的細胞週期分布圖形(Zhao et al., 2012)。
接著我們看(Fig. 3)細胞週期的分布圖形,以Histogram作圖,首先看到X軸,代表螢光強度,這邊要特別留意數值的部分,G1 peak (2N)與G2/M peak (4N)的螢光強度會呈現接近2倍,Y軸則代表細胞的數量,我們也可以從圖中看出,細胞在一般情況下,停留在G1期的時間最長(數量最多)。

Fig.4 . 白藜蘆醇resveratrol處理的非小細胞肺癌細胞株A549,其細胞週期會在G0/G1 phase arrest (Yuan et al., 2015)。
在(Fig.4)中,最左上角是A549未經過藥物處理的細胞週期分布,接著以不同濃度的白藜蘆醇(25 uM、50 uM、100 uM)進行處理,可以發現G2/M phase的peak面積縮小,G1/G0 phase 的peak面積增加,說明白藜蘆醇會造成A549細胞週期停滯在G1/G0 phase (無法通過檢查點)

Fig.5 . 葫蘆素Cucurbitacin B處理的非小細胞肺癌細胞株A549,其細胞週期會在G2/M phase arrest (Guo et al., 2014)。
在(Fig.5)中,最左上角是A549未經過藥物處理的細胞週期分布,接著以不同濃度的白葫蘆素(50 nM、100 nM、200 uM)進行處理,可以發現G1 phase、S phase
的peak面積減少,G2/M phase的peak面積增加,說明葫蘆素會造成A549細胞週期停滯在G2/M phase (無法通過檢查點)
以上為細胞週期實驗的原理以及介紹,接著我們討論在執行實驗的實務上,常會遇到的問題。
1. 首先是執行細胞週期實驗時的Gating strategy,(Fig.6 .)中:
(1)在FSC/SSC的作圖中圈出主要的細胞群。
(2)以FSC-A/FSC-H進行去粘連的作圖。
(3)以DNA含量與細胞數做histogram圖,這邊需要注意,X軸的地方應選擇線性而非對數,選擇線性後應找出G0/G1、G2/M相對應的peak。
一般最單純的gating strategy只會做到第三張圖,但本篇文獻有多染EdU-AF488以標記出S-phase的細胞群以及以phospho-Histone H3標記出M phase的細胞群。

Fig.6 . 以人類纖維母細胞IMR90進行Edu-AF488、phospho-Histone H3-AF555、FxCycle Violet dye染色,其細胞週期的Gating strategy (Lonati et al., 2021)。
2.在未處理任何藥物的細胞組別,就已經跑不出標準圖形(Fig.3),當實驗中的control組出現問題,後面的實驗組便無參考價值,常見的狀況:
(1)訊號分布位置異常(只有單一peak),或無訊號時,可先調整gain值,確認螢光訊號是否落在可被機器偵測的範圍內,並確認X軸的參數是linear而不是log,圈門是否有正確圈出主要細胞群(如果FSC/SSC圖中沒出現主要細胞群,可能是操作流程中細胞已流失,或細胞培養時已嚴重死亡)。
(2)訊號分不開,或是G1/G0、G2/M的peak離相差2倍很遠,有可能是染劑的濃度不足,或是染色時間過短。
(3)S phase的訊號異常高,G0/G1、S、G2/M形成像是山丘形狀,G2/M後面還有許多雜訊,表示RNAse可能失效,殘存的RNA造成高背景。
(4)跑出來的細胞週期圖形已經呈現cell cycle arrest,表示執行實驗時細胞可能種得太滿,或是有其他因素造成培養壓力,使其arrest (如汙染、營養不足、培養環境溫度二氧化碳異常… …)
(5)sub-G1 的比例過高,同第四點,表示細胞在處裡前已有不正常大量死亡,也有可能Main圈選位置過於接近碎片。
若執行細胞週期實驗有跑出漂亮的control組,恭喜已突破這個實驗80%以上的難關!
3. 接著是組別跟組別間的問題,如:
(1) 組別間的peak 跑掉,可能control組G0/G1在200000的位置,G2/M在400000的位置,處理藥物的組別G0/G1 在300000的位置,G2/M在600000的位置,這有可能是細胞數量差距懸殊所造成,因染色時染劑下的劑量各組別一樣,但經過藥物處理後,有些組別細胞變少,就有可能分配到相對多的染劑,造成訊號往右移動變強,這時候的解決方式:
a.治本的做法是每次處理完細胞,在進行固定前做好細胞計數(10^6 cells/mL),使訊號不要相差太遠。
b.若上機上到一半發現此問題,可將訊號較弱的組別再添加染劑反應,使訊號增強(但劑量跟時間不好抓)。
c.若已上完機,從分析的方法上去補救,因大多的機型都有配細胞週期分析的模組,若組別間細胞數差距過大造成訊號偏移,這些模組在套用時就會判斷錯誤,這時應捨棄分析模組,手動拉Histogram並自行定義各期的範圍,其容許的彈性會比模組高。
(2)第二個常遇到的問題是,處理藥物後的細胞形態會產生變化,像是有些藥物除了抑制細胞週期外,也會引發細胞凋亡,此時的細胞大小會變小、顆粒性會變複雜,或筆者也曾經遇到處理藥物後細胞會累積脂肪酸,導致實驗組細胞變得比control組細胞要大顆,造成細胞偏離圈門。若細胞有凋亡的情況,從FSC/SSC的圖形上看就會往左上角移動,重新調整圈門的位置問題即可解決。
若有遇到其他的實驗問題,歡迎隨時與我們進行討論!
Reference
https://jackwestin.com/resources/mcat-content/mitosis/phases-of-cell-cycle-g0-g1-s-g2-m
Guo, J., Wu, G., Bao, J., Hao, W., Lu, J., & Chen, X. (2014). Cucurbitacin B induced ATM-mediated DNA damage causes G2/M cell cycle arrest in a ROS-dependent manner. PloS one, 9(2), e88140.
Kastan, M. B., & Bartek, J. (2004). Cell-cycle checkpoints and cancer. Nature, 432(7015), 316-323.
Lonati, L., Barbieri, S., Guardamagna, I., Ottolenghi, A., & Baiocco, G. (2021). Radiation-induced cell cycle perturbations: a computational tool validated with flow-cytometry data. Scientific Reports, 11(1), 1-14.
Malumbres, M., & Barbacid, M. (2009). Cell cycle, CDKs and cancer: a changing paradigm. Nature reviews cancer, 9(3), 153-166.
Schafer, K. (1998). The cell cycle: a review. Veterinary pathology, 35(6), 461-478.
Yuan, L., Zhang, Y., Xia, J., Liu, B., Zhang, Q., Liu, J., Luo, L., Peng, Z., Song, Z., & Zhu, R. (2015). Resveratrol induces cell cycle arrest via a p53-independent pathway in A549 cells. Molecular medicine reports, 11(4), 2459-2464.
Zhao, S., Xiong, Z., Mao, X., Lu, X., He, G., Han, F., & Yang, G. (2012). Combined effect of N-acetylcysteine (NAC) and plasma on proliferation of HepG2 cells. IEEE Transactions on Plasma Science, 40(9), 2179-2184.




 留言列表
留言列表


